Очерк о медицинских микророботах.
Поздно ночью в октябре 2006 г. техники больницы в Монреале поместили тело свиньи, находящейся в состоянии наркоза, в трубу установки магнитно-резонансной томографии, или МРТ. В крупный кровеносный сосуд свиньи (ниже сонной артерии) введен катетер. В катетер, хирург вводят стальной шарик размером чуть больше, чем шарик от стержня шариковой ручки.
В комнате по соседству, изыскатели из нанолаборатории робототехники затаили дыхание. Они тестировали программу, предназначенную для управления магнитным полем аппарата, который будет направлять шарик так же, как дистанционное управление управляет подводной лодкой.
На экране компьютера шарик появился в виде квадратного белого значка отслеживания, который «сидел» на сером, червеобразном изображении отсканированной артерии. Исследователи смотрели на экран и ждали. Ничего. Секунды шли, а шарик отказывался сдвинуться с места. И вдруг в комнате грянуло громкое УРА! Шарик двигался вверх и вниз по артерии, а белый квадратик исправно отмечал местонахождение шарика в реальном времени.
Это был 1 случай, когда объект в кровеносном сосуде живого существа был удалённо управляем. Эксперимент убедил изыскателей , что можно проектировать миниатюрные роботы для перемещения по огромной сосудистой системе человеческого организма. Микророботы смогут путешествовать глубоко внутри тела, проникая в наши мельчайшие кровеносные сосуды. В места, в которые не могут проникнуть катетеры. Микророботы смогут выполнять задачи, которые были невозможны без инвазивных (травмирующих) процедур.
Легко представить себе много таких задач: тонкие операции, диагностические тесты, установка стентов и других приспособлений. Но первое реальное применение микророботов будет для лечения рака. Сегодня противоопухолевые препараты циркулируют в крови по всему организму, убивая вместе с раковыми клетками и здоровые клетки. Даже антитела, снабжённые противоопухолевыми препаратами, не всегда попадают на свои маркеры. О введении инъекционных препаратов в опухоль не может быть и речи, потому что давление жидкости может выбросить из опухоли раковые клетки и рассеять их в здоровой ткани. Так почему бы не использовать микророботов для доставки лекарств?
Это сложнейшая техническая задача, которая потребует прорыва во многих дисциплинах. Микророботы должны будут двигаться в сложных лабиринтах сосудов, сталкиваясь с тянучей кровью. Что еще хуже, при сегодняшнем уровне техники невозможно построить двигатели и источники питания достаточно малые, чтобы «втиснуть» микророботов внутрь капилляров которые питают опухоль. Диаметр которых всего лишь несколько микрон. Эти сосуды слишком малы для медицинских инструментов, и их невозможно разглядеть без микроскопа. А маневрирование через них можно сравнить с вождением автомобиля с закрытыми глазами.
Тем не менее, несмотря на эти проблемы, изыскатели из политехнической школы г. Монреаля добились огромного прогресса в решении этой проблемы. Они обратились к природе, и заставили стаи плавающих бактерий стать переносчиками противоопухолевых лекарств. Инженеры закапсулировали противоопухолевое лекарство в липосомы и прикрепили их к телам бактерий (рис. сверху).
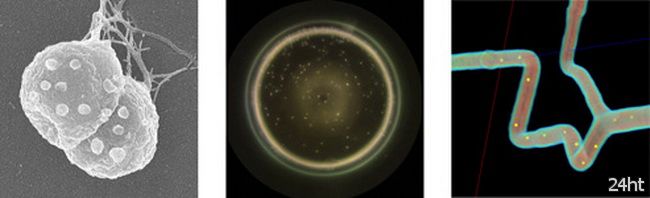
Они затем загрузили бактерий в пузырьки или мицеллы (рис. в центре). Чтобы управлять движением микророботов – мицелл через артерию, они нанесли точки на компьютеризированные изображения сосуда (рис. внизу).
Есть ещё много проблем, но изыскатели верят, что в течение следующего десятилетия микророботы, предназначенные для борьбы с раковыми клетками появятся на рынке. А однажды, микроботы смогут охотиться и убивать раковые клетки, прежде чем они разовьются в опухоли.
Учёные и писатели давно мечтали о миниатюрных роботах, которые могут «бродить» внутри человеческого тела, «вынюхивать» и лечить болезни «ремонтировать» органы. Можно вспомнить старый научно-фантастический фильм 1966 г. «Fantastic Voyage» (фантастическое путешествие), в котором подводная лодка и ее экипаж уменьшается до размера микроба, а лодку отправили в кровеносную систему выдающегося ученого, чтобы разрушить тромб в его мозгу.
В 1959 г. Нобелевский лауреат по физике Ричард Фейнман высказывал похожие фантазии. Как говорил Фейнман: » Было бы очень интересно в хирургии если можно было бы проглотить хирурга.» А друг Фейнмана представлял себе это так: «Маленький механический хирург «марширует» через кровь к сердцу и осматривает его окрестности. Увидев тромб он «берет маленький ножик и вырезает его». Но Фейнман в то время не мог предложить какие-либо практические подходы к проблеме создания медицинских микророботов.»Я оставляю это для вас», объявил он своей аудитории.
А через 4 десятилетия спустя, в 2001 году было создано первое диагностическое устройство под названием PillCam – фактический 1 медицинский микроробот. Одноразовую капсулу из пластика можно проглотить, запивая водой. Она содержит источник света, видеокамеру, аккумулятор, антенну и радиопередатчик. Капсула проходит через желудочно-кишечный тракт, а видеокамера делает множество кадров изображений, которые передаются в виде радиосигналов (радиопередатчик транслирует на пояс-радиоприёмник, закреплённый вокруг талии пациента). Изображения затем анализируются на наличие признаков рака и других заболеваний. Эта процедура менее травмирующая, чем традиционная эндоскопия и более информативная, чем рентгенография.
Но капсула PillCam слишком велика, чтобы путешествовать в других частях тела. К тому же она пассивно перемещается под действием перистальтики органов желудочно-кишечного тракта. А «истинный» медицинской микроробот (microbot) должен себя направлять себя через сложную сеть заполненных коровью сосудов, расположенных в тканях глубоко внутри тела.
Небольшой комментарий от редакции:
Можно подумать, что очевидным путём для решения этой задачи является синтез феполя (одна из моделей вепольного анализа, используемого в ТРИЗ (теория решения изобретательских задач) из моделей – ввести в микророботов ферромагнитные частицы и двигать (и направлять) их магнитным полем постоянного магнита, расположенного снаружи тела. Действительно, некоторые магнитные наконечники хирургических катетеров работают таким образом. Но постоянный магнит создает ряд проблем для микророботов. Например, постоянный магнит должен быть расположен достаточно близко, чтобы магнитное поле могло притягивать их с достаточной силой. Но микророботы смогут работать только вблизи кожи и двигаться только в одном направлении – в сторону магнита. А как управлять ими? По мере приближения к магниту, напряжённость магнитного поля будет возрастать. Будет возрастать и ускорение робота, что сделает невозможным изменение его направления движения, если он сбился с пути. Как быть?
Чтобы улучшить управляемость феполя, нужно перейти от постоянного магнитного поля – к переменному, градиентному, структурированному. Все эти возможности представляет установка магнитно- резонансной томографии или, коротко, МРТ.
Чтобы понять, как МРТ можно использовать для навигации (обеспечения движения в нужном направлении) миророботов, нужно знать кое-что о том, как она работает. Основная часть установки представляет собой мощный сверхпроводящий магнит, который создает магнитное поле примерно в 60 000 раз сильнее магнитного поля Земли. Задача этого поля – сориентировать в одном направлении «спины» (собственные моменты) протонов — ядер атомов водорода — в теле. Дело можно представить так, что все протоны, как стрелки компаса, ориентируются в направлении окружающие поля.
Внутри большого магнита скрываются радиочастотная катушка, которая излучает радиоволны. Когда частота волны радиоимпульса согласуется со скоростью вращения протонов (резонанс), спины протонов «переворачивает» своё направление на 90 градусов. Когда импульс заканчивается, протоны «расслабляются» – переходят опять в их исходное состояние с сориентированными спинами (в более низкое энергетическое состояние). Потерянная энергия излучается как радио сигнал, который улавливается приемником. Плотность радиосигналов дает информацию о молекулярном составе тканей тела, позволяет отличить кости от крови, белое вещество мозга от серого вещества, опухоли от здоровых тканей.
А чтобы знать, из какого места тела человека излучаются сигналы, используется еще 1 набор градиентных катушек, расположенных между основными магнитом и радиочастотной катушкой. Градиентные катушки генерируют неравномерное магнитное поле, что делает основное магнитное поле сильнее в некоторых местах и слабее в других. Это изменение магнитного поля изменяет частоту сигналов протонов в зависимости от их расположения в поле. А поскольку поле неравномерное, то компьютер вычисляет их местоположение в организме. По пульсирующим градиентному магнитному полю и полю радиочастотных катушек (включая и выключая их в различных сочетаниях), установка создаёт трехмерное изображение.
Градиент магнитного поля, делает проблематичным присутствие металлические предметов в трубе МРТ установки. Потому что сила неравномерного магнитного поля может сильно дёрнуть металлический предмет в теле человека (например, кардиостимулятор или пулю).
Но есть способ обойти «проблему пули». Рассмотрим эксперимент со свиньёй. Во-первых, пока металлический шарик скользит через катетер в артерию, включен только главный магнит. Его поле сильно притягивает шарик. А потому, что поле однородно, шарик не двигается. В этом «сверх намагниченном» состоянии, небольшой «буксир» из градиентных катушек будет градиентным магнитным полем подталкивать шарик вперед без увеличения его намагниченности. Это предотвращает шарик от резкого ускорения к источнику магнитного поля (как это было бы в присутствии постоянного магнита) и позволяет управлять ускорением шарика. Наложение на постоянное магнитное поле градиентных магнитных полей позволяет уменьшить размер микроробота и перемещать его по кровеносным сосудам в любую точку тела с помощью относительно слабых градиентов.
Эксперимент со свиньёй доказал концепцию. Но голый 1,5-миллиметровый металлический шарик не используешь для перевозки противоопухолевого лекарства внутри микрососудов человеческого тела. Поэтому, изыскатели начали проводить эксперимент с наночастицами из сплава железа и кобальта. Они являются более чувствительными к магнитным силам, чем другие нетоксичные сплавы металлов. Наночастицы покрывали графитом, чтобы защитить их от окисления, а потом помещали их вместе с молекулами противоопухолевого препарата доксорубицина в биоразлагаемый полимерный «мешок».
Можно уменьшать размеры таких микророботов до нескольких сотен микрометров. Но для последующего уменьшения размеров микророботов нужно увеличивать мощность градиентных катушек. Исследователи уменьшили размер микророботов до 50 мкм. Но это предел: для последующего уменьшения размеров потребуется настолько сильные градиенты, что они становятся опасными для клеток центральной нервной системы организма.
В 2011 году учёные протестировали эти микроносители на кроликах. Они ввели их небольшое количество в печеночную артерию, которая снабжает кровью печень и другие близлежащие органы. Как и в эксперименте со свиньёй, использовалась усовершенствованная компьютерная программа навигация с помощью МРТ, которая автоматически регулировала градиент магнитного поля. Хорошо различимое черное пятно в одной доле печени доказало, что крошечные микророботы попали в нужное место. Они прошли через печёночную артерию, сделали резкий поворот на бифуркации, а затем собрались в нужной точке. Когда их полимерные оболочки растворились, микророботы привели в действие своё лекарственное «оружие. Хотя в этом эксперименте, у кролика не было никакой опухоли.
Итак, микроносители могут быть идеальным средством для лечения рака печени у людей, потому что сосуды, питающие доли печени, имеют довольно большие размеры (около 150 мкм или больше). Но чтобы добраться до опухоли, которые скрываются за сетью меньших капилляров, (например, в груди или в толстой кишке), нужны микророботы с размерами не более нескольких микрометров. И потом, как говорилось выше, биологический предел мощности градиентных катушек позволяет осуществлять навигацию микророботов размерами более 50 мкм. Таким образом, микророботы должны САМИ продвигать себя по капиллярам. Как быть?
К счастью, биологические «микророботы» с нужными свойствами уже существуют в природе.
В 1993 году в небольшом устье соленой реки была впервые найдена уникальная бактерия MC-1. Она имеет сферическое тело размером около 2 мкм в поперечнике. И на её тело можно прикрепить довольно много молекул лекарства против рака. Бактерия также имеет пару вращающихся хвостов, которые работает по принципу молекулярного «роторного двигателя», что позволяет бактерии плыть сквозь воду через воду со скоростью в 150 раз больше, чем длина её тела (в секунду). Но самое главное, MC-1 является магнитной. Этот вид бактерий относится к группе бактерий, описанных как магнитотактические, потому что они имеют особое свойство, чувствовать и ориентироваться по магнитному полю Земли.
В бактериях есть нанокристаллы магнитного оксида железа, которые ведут себя подобно стрелке компаса. И бактерии ценят плыть вдоль силовых линий магнитного поля Земли в направлении северного магнитного полюса. Хотя неясно, зачем это им нужно.
Для управления движением бактерий, нужно генерировать лишь очень слабое магнитное поле, чуть сильнее, чем естественное магнитное поле Земли. Специально разработанных электромагнитных катушки (значительно менее мощные, чем у МРТ установки) создают в месте расположения опухоли «искусственный Северный полюс». И бактерии плывут по сосудистой сети к этом искусственному Северному полюсу. В горячей крови млекопитающих, микробы выживают только около 40 минут, поэтому опасность «заражения крови» отсутствует.
Были продемонстрированы возможности этой системы на мышах. После введения бактерий в сосуды хвоста, был создан искусственный Северный полюс на одной из 2 опухолей, присутствующих в мышином организме. После анализа и исследовали опухолей, было найдено больше бактерий в целевой опухоли, чем во 2 . Но результаты были не идеальны. К сожалению, большая часть бактерий не добралась до опухоли. Многие бактерии погибли в крупных сосудах хвоста, прежде чем они смогли достичь капилляров со спокойным течением крови.
Исследователи предлагают 2 решения этой проблемы.
Во-первых, бактерии MC-1 могут быть использованы специально для лечения колоректального рака. Из толстой кишки (легко доступной через прямую кишку) с помощью катетера бактерии могут быть введены в сосуд, расположенный близко к опухоли. И у них будет больше шансов добраться до цели.
Второе решение – создание гибридного микроносителя. Бактерии-микророботы можно поместить в пузырьки жира (мицеллы) с магнитными наночастицами. Сначала мицеллы можно перемещать через крупные сосуды при помощи магнитного поля установки МРТ, пока узкие сосуды преградят им путь. Тогда пациент будет переведен из МРТ установки в установку для навигации бактерий с менее мощными катушками. Руководствуясь магнитным полем этих катушек, вооруженные противоопухолевым лекарством бактерии будут плыть в опухоль. И там они умрут, освобождая свой смертоносный для раковых клеток груз.
Пройдёт ещё несколько лет, прежде чем такие медицинской микророботы будут использоваться у пациентов. Есть еще много вопросов, на которых пока нет ответов. Сколько роботов необходимо для надёжного уничтожения опухолевых клеток? Какое количество бактерий является безопасным для введения в организм человека? Как на них отреагирует иммунная система?
К счастью, изыскатели из Монреаля не одиноки в решении этих проблем. Робототехники во всем мире изобретают целое семейство крошечных устройств для различных задач.
А теперь посмотрим, какие уже существуют миниатюрные роботы для медицинского применения. Вот некоторые из наиболее инновационных проектов.
Управляемый хирург
 Ведущий инженер: Брэд Нельсон, Швейцарский федеральный технологический институт, Цюрих, Германия.
Ведущий инженер: Брэд Нельсон, Швейцарский федеральный технологический институт, Цюрих, Германия.
Конструкция: 3-D инструмент собран из плоских никелевых деталей.
Источник питания: внешние электромагнитные катушки.
Рулевой механизм: градиентное магнитное поле.
Отслеживающие устройства: микроскоп.
Размер: (длина): 1 мм.
Применение: операции на сетчатке глаза, медикаментозная терапия при глазных болезнях.
Статус: навигация была протестирована в глазах кроликов.
Робот-таблетка
 Ведущий инженер: Паоло Дарио, Scuola Superiore Sant’Anna, Пиза, Италия.
Ведущий инженер: Паоло Дарио, Scuola Superiore Sant’Anna, Пиза, Италия.
Конструкция: капсула содержит магнит, камера, беспроводной чип, и набор механических ногах.
Источник питания: двигатели постоянного тока, магниты вне тела.
Рулевой механизм: градиент магнитного поля.
Отслеживающие устройства: камеры, беспроводные системы телеметрии.
Размер (длина): 2 см.
Применение: Диагностика болезней желудочно-кишечного тракта.
Статус: Визуальный осмотр кишечника свиньи.
Микроробот для удаления артеросклерозных бляшек
 Ведущий инженер: Jong-Oh Park, Чоннам национальный университет, Южная Корея.
Ведущий инженер: Jong-Oh Park, Чоннам национальный университет, Южная Корея.
Конструкция: магнитные капсулы оснащены микро буровой головкой.
Источник питания: электромагнитные катушки.
Рулевой механизм: градиент магнитного поля.Отслеживающие устройства: МРТ и рентгенография.
Размер: (длина): 10 мм
Применение: удаление бляшек в артериях
Статус: Прототип в настоящее время разрабатывается.
Магнитные микроносители
 Ведущий инженер: Sylvain Martel, Политехническая школа Монреаля.
Ведущий инженер: Sylvain Martel, Политехническая школа Монреаля.
Конструкция: Магнитные наночастицы и противораковые лекарственные средства заключены в биоразлагаемый полимерный «мешок».
Источник питания: МРТ установка.
Рулевой механизм: градиенты магнитного поля.
Отслеживающие устройства: МРТ.
Размер: (диаметр): 50 мкм.
Применение: доставка противораковых лекарств.
Статус: навигация и высвобождение лекарственного средства были испытаны на кроликах.
Микророботы-бактерии
 Ведущий инженер: Метин Sitti, Университет Карнеги-Меллона в Питтсбурге.
Ведущий инженер: Метин Sitti, Университет Карнеги-Меллона в Питтсбурге.
Конструкция: Бактерии самостоятельно прикрепляются к полимерным гранулам.
Источник питания: Жгутики живых бактерий
Рулевой механизм: Градиенты химических веществ, температуры, кислотности.
Отслеживание устройства: флуоресцентные или рентгеновские установки.
Размер: (диаметр): 55 мкм.
Применение: диагностика заболеваний и доставка лекарственных средств
Статус: Химическая навигация была протестирована в лаборатории.
Микроробот-плавец со «штопором»
 Ведущий инженер: Джеймс Френд, Королевский технологический институт Мельбурна, Австралия.
Ведущий инженер: Джеймс Френд, Королевский технологический институт Мельбурна, Австралия.
Конструкция: капсула содержит пьезоэлектрический поворотный двигатель, который «хлещет» хвостом.
Источник питания: беспроводная передача электроэнергии.
Рулевой механизм: пьезоэлектрические колебания.
Отслеживание устройства: рентгенография.
Размер: (диаметр): 250 мкм.
Применение: исследование сосудов.
Статус: Испытания в лабораторных условиях.
Автор: Sylvain Martel директор NanoRobotics Laboratory, Монреаль http://spectrum.ieee.org/robotics/medical-robots/magnetic-microbots-to-fight-cancer
Перевод и добавления: Олег Сарычев



Нет комментарий